Cet article a pour but d’aider les internes et autres médecins à exploiter au maximum leur arsenal d’oxygénation et de ventilation non-invasive aux urgences / SMUR, et spécifiquement dans ce milieu. En effet la médecine d’urgence a ceci de particulier que la logistique et le contexte sont des paramètre aussi importants à prendre en compte que le médical (afflux, débordement des moyens humains, disponibilité et nombre des ventilateurs, possibilité de surveillance, isolement ou éloignement) dans un environnement non normé, afin de faire face à un débit et un nombre de patient virtuellement illimité sur une période donnée.
Nous n’insisterons donc pas sur certains aspects de ventilation non-invasive plus élaborés qui ont leur place dans des services de soins critiques (soins continus, réanimation) sur du plus long terme. En revanche, penser qu’il est inutile d’approfondir un minimum ces méthodes car le patient montera tôt ou tard en USC ou réanimation est probablement une erreur. La tendance aux fermetures de lits (y compris de soins critiques) l’éloignement et l’isolement de certains services d’urgence (certains sans accès à un de ces services sur site), et l’augmentation continue de l’afflux, amène et amènera de plus en plus l’urgentiste à gérer ces situations à la phase initiale, des heures, et parfois des journées… il est donc dans notre intérêt de maîtriser solidement les bases de ces prises en charge, afin d’éviter toute perte de chance, et parce que le déchocage fait partie intégrante de la spécialité de médecine d’urgence.
Contrairement à d’autres thématiques, la ventilation non-invasive aux urgences est un sujet qui souffre de nombreuses contradiction en terme de littérature et de niveau de preuve. Je vous exposerai donc des méthodes qui sont propres à mon service / mon habitude, et comprendrais que certains puissent agir différemment, avec le même niveau de justesse par rapport aux données actuelles de la science. Cet article aura surtout pour intérêt d’éviter de commettre certaines grandes erreurs courantes, et d’assimiler les grands principes.
Je n’ai aucun conflit d’intérêt, que ce soit avec un laboratoire ou un prestataire de machine, concernant les dispositifs dont je vais parler très librement en fonction de la place qu’ils occupent dans ma pratique et de l’intérêt que je leur trouve. Il s’agit souvent (et je le précise alors) d’avis personnels qui n’engagent que moi.
I) Dispositifs d’oxygène communs non spécialisés
Le début de l’oxygénation passe par les dispositifs les plus simples, notamment ceux auxquels ont accès les services d’hospitalisation conventionnels (dotation O2 classique, et contenu du chariot d’urgence), avec lequel le médecin d’étage aura à composer avant votre arrivée. Bien qu’à priori simple, ces situations méritent quelques précisions.
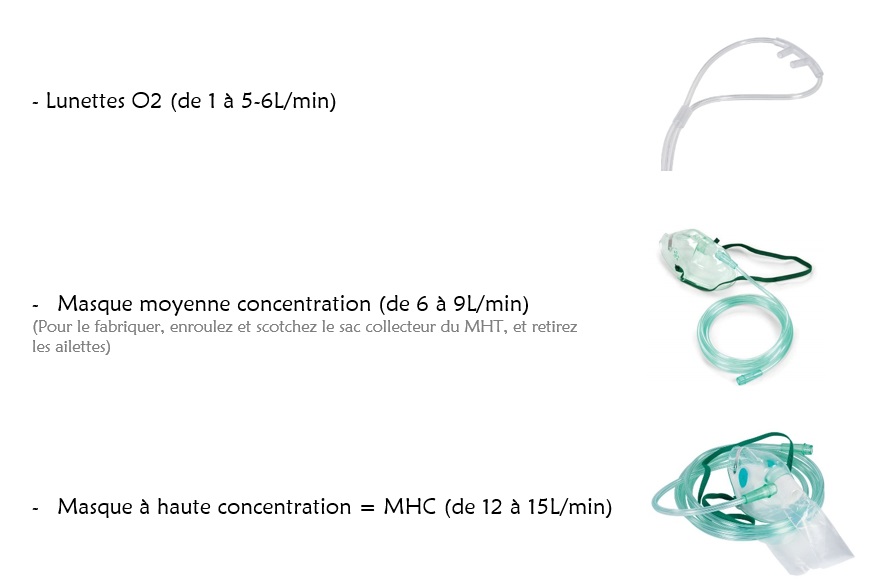
L’administration d’O2 à un patient se retrouvant en détresse respiratoire hypoxique en service se fait en fonction du débit:
A priori arrivé au dernier point, on est au maximum, le médecin polyvalent dans son service de médecine est arrivé au bout de son arsenal. Est-ce le cas ? Oui et non.
Une fois sous MHC à 15L/min, la FiO2 (fraction inspirée d’oxygène) du patient n’est pas de 100% comme on pourrait l’imaginer, mais plutôt de 60-70%. Et en réalité ce chiffre va dépendre de multiples paramètres, du patient déjà et de sa morphologie (notamment via les abondantes fuites de ce masque non hermétique), la FiO2 variant d’un patient à l’autre (1), mais aussi du niveau de détresse respiratoire du patient, et donc de sa ventilation minute (= fréquence respiratoire x volume courant). Plus le patient ventilera vite et/ou prendra de grands volume car très en détresse, plus le débit de 15L/min s’avèrera insuffisant pour répondre aux besoins. En cas de détresse ce débit inspiratoire de pointe approchera plutôt des 20-30L/min, et parfois même beaucoup plus… à ce stade nous comprenons que le débit maximal classique d’O2 s’arrêtant à 15L/min ne fait plus le poids quelque soit le dispositif.
Le seul matériel à disposition dans les étages permettant d’optimiser la FiO2, est le BAVU (disponible dans le charriot d’urgence). En effet, poser le BAVU sur le visage du patient en détresse (sans ventiler, c’est inutile puisqu’il est en ventilation spontanée), permet via l’hermétisme supérieur des masques BAVU, et le sac collecteur d’O2, de réunir davantage de conditions pour une administration complète du débit d’O2 libéré… encore faut-il qu’il soit suffisant. Sur un débit-litre limité à 15L/min, si le patient est en grande détresse on ne fera pas de miracle. Se doter d’un débit-litre en prise murale plus important (au delà de 30L) est une solution peu coûteuse et intéressante.
Vous êtes en tout cas désormais au bout de votre arsenal de médecin polyvalent de service d’étage. Si ça ne va toujours pas (et même si ça va, vous êtes quand même sous 15L/min on vous le rappelle, c’est une situation de détresse respiratoire…) vous allez devoir composer le numéro du téléphone rouge, et appeler un médecin criticien pour passer à la suite, qui aura lieu en déchocage.
II) Supports non invasifs: C-PAP et VNI
C’est une question de sémantique, mais je préfère séparer ces deux appellations, quand certains diront « VNI » en englobant la C-PAP et la VNI (BiPAP). Les réunir (alors que la C-PAP n’est pas en soit de la véritable ventilation) tend à nous faire oublier qu’il existe une différence entre les deux, physiologique, mais aussi en applications et indications en pratique clinique.
1) La C-PAP
Pour « Continuous Positive Airway Pressure ». C’est un dispositif fournissant uniquement une PEP (pression expiratoire positive), dans la mesure où il s’agit très simplement d’un soufflet continu, sans finesse, sans adaptation particulière au patient, sans variation en fonction du moment de l’inspiration ou de l’expiration… c’est juste un soufflet continu dont on règle le débit. On peut aussi appeler la C-PAP la VS-PEP (ventilation spontanée + pression expiratoire positive).
Plus le débit sera élevé, plus, lors de l’expiration, le patient ira se heurter à un mur de pression. Ce puissant flux venant s’opposer à l’expiration du patient, qui peut être soit un flux d’O2 pur dans les dispositifs les plus simples, soit un mélange air / O2 (avec FiO2 réglable) sur les machines plus perfectionnées, va créer une pression importante dans les voies aériennes et permettre de maintenir les alvéoles ouvertes, voire de réouvrir des alvéoles collabées, sur leur tendance à s’affaisser / s’atélectasier naturellement à l’expiration. On diminue ainsi l’effet shunt, ce qui permet en reventilant une portion fonctionnelle plus importante du poumon, de lutter contre l’hypoxémie.
La C-PAP est un dispositif à mes yeux essentiel, qui semble être tombé en désuétude dans certains services avec l’avènement de la VNI sur ventilateur. Or il n’est pas nécessaire d’avoir un ventilateur pour faire de la C-PAP, et par ailleurs l’absence d’adaptation au patient ne requiert pas de synchronie patient-ventilateur, c’est donc un dispositif plus simple à régler, et moins demandeur de surveillance qu’une VNI. Et si cette information est relative en réanimation, où les moyens en terme de ventilateur et de disponibilité de personnel ne sont pas une limite, elle devient capitale en médecine d’urgence, où contexte et logistique, surtout en période d’overcrowding (urgences saturées), peuvent faire la différence sur des patients graves en trop grand nombre.
Les indications:
La première indication reconnue de la C-PAP est l’OAP (2). Car en réalité la C-PAP fonctionne comme un OAP à l’envers. Imaginez un cas d’OAP cardiogénique, le coeur gauche remplit insuffisamment son rôle d’éjection du sang, peut-être parce qu’on lui apporte trop de volémie pour ce qu’il est capable d’éjecter, et/ou le ventricule gauche (VG) a un trouble important de la relaxation, ce sang va donc monter en pression en amont de la pompe cardiaque et le système vasculaire pulmonaire va devenir de plus en plus congestif jusqu’à faire sortir par gradient de pression du plasma dans les alvéoles, diminuant la compliance pulmonaire et augmentant les résistances des voies aériennes (3).
La C-PAP agit exactement à l’opposé, elle va par sa pression expiratoire positive faire régner une telle pression dans les voies aériennes, que le gradient va s’inverser, et l’eau va cesser de sortir des capillaires pulmonaires par opposition à la pression hydrostatique, permettant ainsi de recruter du volume pulmonaire / alvéoles, pendant que les effets hémodynamiques de cette pression positive vont en même temps diminuer la post-charge VG, et probablement baisser la précharge VD puis VG par diminution du retour veineux. L’indication semble donc logique, d’autant qu’il s’agit d’un phénomène dynamique et rapidement réversible (contrairement à une pneumopathie, où les atteintes pulmonaires sont installées pour plus longtemps).
Une autre grande indication de la C-PAP est la noyade… là aussi on reste dans la plus pure logique, tout d’abord parce que la noyade est un OAP, certes d’origine lésionnelle, mais ce n’est pas de l’eau de mer qu’on va devoir chasser des poumons, il s’agit d’une irritation initiale avec de très infimes quantités d’eau de mer, qui créeront bien un OAP par extravasation plasmatique dans les alvéoles.
Tout ceci rassemble ce qu’on appelle aussi les insuffisance respiratoires de type 1. Le problème est ici l’hypoxie, il y a une atteinte / un comblement alvéolaire, alors que la pompe respiratoire (muscles intercostaux, diaphragmes) est compétente.
Les dispositifs:
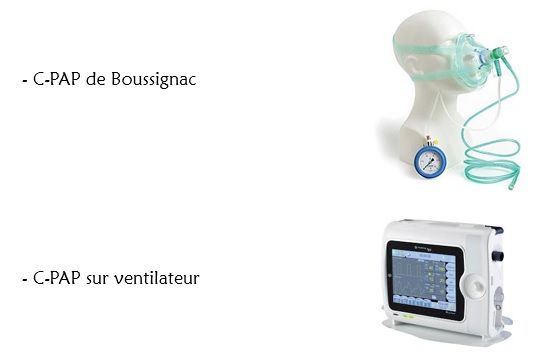
- Le dispositif le moins coûteux et le plus basique, reste l’indémodable C-PAP de Boussignac, inventée il y a des décennies par le Dr Boussignac, elle est à la fois extrêmement simple, et très rustique, elle tient dans une petite mallette légère qui peut être transportée partout notamment en préhospitalier, et est tellement simple de mise en place que dans beaucoup de services les IDE sont habitués à les poser. Un débit-litre montant au delà de 30L permet d’envoyer de l’O2 pur à très haut débit dans un petit connecteur avec plusieurs micro-cannaux qui créent un flux turbulent, assurant une pression dans les voies aériennes proportionnelle au débit d’O2 envoyé. Un masque de BAVU est utilisé pour ce dispositif, et un simple manomètre vérifie la montée des pressions en fonction de l’augmentation du débit. Pour régler la PEP rien de plus simple, ne regardez même par le débit que vous administrez, surveillez simplement le manomètre. L’aiguille donnera une valeur basse et une valeur haute de pression en fonction du cycle respiratoire du patient. La valeur haute (lors de l’expiration) est la PEP. Montez le débit jusqu’à être dans votre fourchette de PEP efficace (voir les réglages des valeur de PEP au chapitre suivant). Il s’agit tout de même d’un dispositif très bruyant et qui peut donc surprendre le patient, veillez à commencer tranquillement, pas d’emblée à des PEP élevées, puis montez progressivement.
- Certains ventilateurs ont un mode CPAP dédié qui permet de ne faire que de la CPAP. Là le réglage est encore plus simple, on règle la PEP et la FiO2 sur les paramètres du respirateur, la machine fait le reste. La possibilité d’associer une humification / un réchauffement est intéressante pour le confort.
- Il est possible de faire de la CPAP sur des colonnes d’oxygénothérapie haut débit de type Optiflow (nous parlerons de ces dispositifs plus tard). Il suffit de régler le débit sur le maximum (60L/min), la FiO2 comme on le souhaite, et de relier le tout à un masque avec valve de PEP, réglée à la valeur de son choix. Cela permet aussi un flux humidifié et réchauffé très confortable et silencieux.
Les réglages:
Nous considérons une PEP active (pour une problème aigu nécessitant une PEP urgente) comme une valeur élevée situé entre 8 et 10 cmH2O. Mon objectif est d’arriver rapidement à 10, maintenu ensuite pour toute la durée de la séance. Au delà de 10cmH2O, il n’y a pas de preuve supplémentaire de meilleurs résultats sur un OAP, et les risques inhérents aux pressions augmentent. Des pressions basses à 4 ou 5cmH2O mettront probablement nettement plus de temps à repousser l’œdème des alvéoles, car le gradient de pression sera inférieur, elles sont à mon sens insuffisante dans ces situations, souvent explosives avec des patients cyanosés et en tirage majeur, et ce n’est pas notre pratique dans le service.
Pour les C-PAP sur ventilateur autorisant un réglage de la FiO2, le mieux est de la titrer, comme un médicament, en la mettant à une valeur minimale pour permettre une SpO2 à 95%, puisque nous sommes dans une situation d’hypoxie sévère. Une fois l’épisode aigu passé, il sera temps de reconsidérer cet objectif en fonction des antécédents du patient.
Dans les indications de la C-PAP, définies par une importante réversibilité, vous verrez que l’efficacité sera observée très rapidement, le plus souvent en 15-20min. Il arrive qu’un patient en détresse majeure, cyanosé et au bord de l’ACR hypoxique à la prise en charge, arrive aux urgence presque confortable et pouvant parler, grâce à la C-PAP mise en route sur site, puis durant tout le transport avec le SMUR. Une séance d’1h est donc généralement suffisante pour réévaluer et juger de l’efficacité, et on a bien souvent même pas à en faire de suivantes, quand le problème est un OAP pur et aidé des autres thérapeutiques (vaso-dilatateurs tels le risordan, diurétiques si ils sont nécessaires).
2) La VNI (BiPAP)
La VNI, dite « BiPAP » (Bilevel Positive Airway Pressure) est comme son nom l’indique à deux niveaux de pression, il y a deux paramètres distincts, on retrouve la PEP, et s’y ajoute l’AI (Aide Inspiratoire), qui est cette fois un paramètre ventilatoire qui va nécessiter une véritable synchronisation entre patient et ventilateur, en effet l’AI est un support en pression qui est administré au moment où le patient inspire (la machine détecte l’inspiration, et envoie une pression donnée à ce moment là), afin de soulager et suppléer le travail ventilatoire, au niveau « pompe musculaire » du terme, c’est à dire les efforts nécessaires au patient pour assurer sa ventilation minute. La VNI d’urgence se fait sur un ventilateur spécialisé pour l’urgence-réa, ce sont des machines coûteuses et performantes, elle nécessite une équipe entraînée et un médecin criticien urgentiste ou réanimateur habitué à utiliser ce dispositif. Ces ventilateurs permettent de sélectionner la FiO2 de son choix, et donnent accès à de multiples paramètres de réglages fins que nous verrons un peu plus loin.
A noter, certains appareils fonctionnent avec réglages de IPAP et EPAP. La IPAP = PEP+AI. Le EPAP = PEP.
Les indications:
La principale indication reconnue de VNI est l’insuffisance respiratoire aigu du patient insuffisance respiratoire chronique, le cas caricatural et le plus important à connaître aux urgences est le BPCO en décompensation (4) (un cas d’insuffisance respiratoire obstructive), qui s’est épuisé sur cet épisode aigu et n’arrive plus à assurer sa ventilation minute. Ce patient est en hypoventilation alvéolaire, qui peut s’identifier à la gazométrie par une acidose respiratoire, c’est elle qui pose l’indication de VNI. Il est important de considérer ce terme dans son entièreté… l’acidose seule peut très bien être d’autre cause (si il est septique, c’est peut-être une acidose métabolique sur un sepsis), et par ailleurs chez un BPCO suffisamment sévère, l’hypercapnie est probablement présente toute l’année à l’état normal, la pCO2 seule n’est donc pas un bon paramètre et n’est pas suffisante pour juger d’une indication de VNI urgente.
Astuce: lorsque vous êtes confronté à une hypercapnie sur une gazométrie, observez le pH et le bicarbonate (HCO3). Si le pH est normal et le HCO3 élevé, c’est une hypercapnie à priori chronique et normale pour le patient, issue d’une insuffisance respiratoire chronique, et qu’il compense toute l’année par son rein (qui augmente le HCO3 pour tamponner). Ce mécanisme de compensation est lent à se mettre en place (48h), il ne sera donc pas présent chez un sujet non chronique en décompensation aiguë aux urgences.
Revenons donc à notre patient, vous avez identifié un patient en détresse respiratoire. L’acidose hypercapnique atteste que le patient ne parvient pas à compenser cette détresse en augmentant son travail respiratoire pour assurer une bonne ventilation alvéolaire. Il lui faut de l’aide. C’est ici que l’AI prend tout son sens. La VNI intervient donc dans ce qu’on appelle des insuffisances respiratoires de type 2, il n’y a pas forcément d’agression au niveau des alvéoles, mais la pompe respiratoire est défaillante. L’AI va permettre à effort égal au patient de prendre un volume courant (Vt) plus important (bien que ce Vt ne soit pas réglable sur la machine, on ne règle que l’AI, et l’augmentation du Vt sera un reflet indirect, que certaines machines peuvent monitorer d’autres pas). Ainsi on améliore la ventilation minute du patient, et on va pouvoir diminuer sa capnie et tendre à normaliser son pH.
Un peu plus rare aux urgences:
*Parmi les indications reconnues de VNI on retrouve également les troubles ventilatoires restrictifs, tels que des patients atteints de maladies neuro-musculaire rendant la pompe musculaire respiratoire défaillante (myopathies, SLA…), ou atteints de fibrose pulmonaire. Ces patients bénéficient eux aussi de l’AI qui va venir aider, remplacer en partie l’effort musculaire nécessaire pour assurer leur ventilation minute.
*Le syndrome d’obésité-hypoventilation apparaît chez certains patients obèses, dont la surcharge pondérale entraîne une diminution du volume pulmonaire, de la CRF, un remaniement des muscles respiratoires et des troubles de compliance de la paroi thoracique. On notre des composantes restrictives et obstructives, variables entre les individus (notamment en fonction de l’association à un syndrome d’apnée du sommeil qui est distinct), certains sont traités par PPC (pression positive continue simple), d’autre par VNI (BiPAP) à domicile.
*L’indication de la VNI BiPAP dans l’asthme chez l’adulte et surtout chez l’enfant, est toujours en cours d’étude et souffre pour l’instant d’une littérature limitée. Certaines équipes pédiatriques y ont recours en routine chez l’enfant asthmatique sévère.
Attention: la pneumopathie hypoxémiante pure (sans OAP, ni hypercapnie) n’est pas une indication de VNI. Dans cette situation précise, elle pourrait même être délétère et augmenter la mortalité (5), cf chapitre Optiflow.
Les réglages:
Il existe des réglages principaux (PEP, AI, FiO2) et des réglages fins (Pente, Trigger, Cyclage).
PEP: Dans une situation typique de VNI de BPCO, la PEP n’a pas de fonction « active » comme pour repousser en urgence un œdème pulmonaire. Elle est surtout là pour compenser l’auto-PEP (ou PEP intrinsèque) du patient BPCO, entraînée par le trapping d’air dans les alvéoles due à la sévérité de l’obstruction chez certains de ces patients. Ainsi la PEP du ventilateur est parfois appelée PEP externe.
Pour permettre qu’un débit d’air circule d’un bout du tuyau A à un bout du tuyau B, il faut que la pression du point A soit plus importante que celle du point B… ainsi si le patient a une auto-PEP (pression positive résiduelle au niveau des alvéoles), pour inspirer (donc déclencher une pression négative), il va d’abord avoir besoin de vaincre son auto-PEP, avant de fournir le travail nécessaire au reste de l’inspiration normale, ça lui ajoute donc un effort inspiratoire supplémentaire. On dit qu’un réglage de 4 à 6 cmH2O de PEP sont des chiffres habituels pour une séance de VNI chez un BPCO afin d’anticiper la possible auto-PEP du patient et la compenser. Des efforts inspiratoires non récompensés d’un déclenchement (visibles à l’effort du patient, et sur les courbes de votre machine) sont le signe que la PEPi (auto-PEP) n’est pas compensée par la PEPe (PEP externe) qui est donc insuffisante.
AI: elle doit être d’instauration progressive, elle est réglée au départ à un minimum de 8 cmH2O, puis elle sera montée progressivement en ne manquant pas de demander au patient son ressenti « y a-t-il assez d’air qui arrive? » si non, il faut augmenter l’AI. Si une séance a commencée depuis un moment (1h par exemple) et que la FR reste élevée -paramètre le plus important pour juger de l’efficacité-, ou que le patient prend des volumes courants expirés inférieurs à sa physiologie théorique (6-7 mL/kg de poids idéal théorique), il faut probablement essayer de monter l’AI. La limite supérieure de l’AI est l’inconfort (« trop d’air qui arrive ») et surtout les fuites. Pour limiter ces problèmes, il faut une bonne interface (le bon masque au bon patient), prendre le temps de l’installer méticuleusement, de le serrer à deux personnes, de contrôler les fuites surtout dans les premières minutes. Dans l’idéal commencez par quelques minutes le masque tenu par votre main sans le serrer, afin de mettre le patient confiance, avec une AI minimale, si le patient est anxieux ou agité ça aidera à l’adhésion (et à la réussite) de la séance.
On lit souvent que la pression inspiratoire totale (PEP+AI) doit être < 20cmH2O (dans l’optique de ne pas excéder la pression de fermeture du cardia de l’œsophage, et créer des régurgitations par insufflation d’air dans l’estomac). En pratique clinique il y a peu de preuves soutenant cette affirmation, je préfère ne pas retenir cette barrière absolue (que certaines équipes outrepassent sans retenue s’ils le jugent nécessaire), et davantage me fier à la tolérance clinique et aux fuites pour limiter l’AI.
FiO2: Tout dépendra du patient, mais chez un patient BPCO mieux vaut viser des objectifs de SpO2 bas, et régler la FiO2 la plus basse possible pour une SpO2 88-92% (6).
Trigger inspiratoire: c’est la pression nécessaire au déclenchement de l’inspiration. Pour améliorer le confort et éviter au patient des efforts inspiratoires supplémentaires, on tend à régler le trigger le plus sensible (donc le plus bas) possible, sans qu’il soit assez bas pour faire des auto-déclenchements. Généralement on arrive à descendre à 1 ou 1,5 cmH2O. En cas d’auto-déclenchements, il faudra augmenter le trigger (le rendre moins sensible) jusqu’à leur disparition, par exemple à 2 cmH20, etc…
Pente: elle doit être au plus raide pour un BPCO afin d’améliorer le confort tout en laissant plus de temps à l’expiration, 50mS est un réglage classique chez un obstructif. On peut mettre des pentes plus longues (100mS voire davantage) chez des patients restrictifs (maladie neuromusculaire).
Cyclage: c’est le moment où le ventilateur va passer en phase d’expiration (on l’appelle aussi trigger expiratoire), définit par le % du débit inspiratoire à partir duquel l’expiration débute. Chez un BPCO mieux vaut régler une valeur élevée, 45 à 60% par exemple, afin de laisser une longue part à l’expiration qui sera gênée par le syndrome obstructif. Chez un patient restrictif on pourra le régler à l’inverse à des valeurs plus basses, 20% par exemple.
La VNI contrairement à la C-PAP se fait en séances longues, pour une première séance en urgence une durée de 4h est indiquée. Les contrôles gazométriques intempestifs et répétés ne sont pas utiles, la surveillance et la modification des réglages est clinique en priorité, on peut faire un contrôle gazo à mi-séance (H2) à la rigueur, mais je préfère ne faire de contrôle qu’à la fin (H4) et pas avant.
4) Les différentes situations clinique, et les situations mixtes
Ces situations qui peuvent voire une indication des deux dispositifs, amène une grande variabilité de pratiques en fonction des services. Il est utile de réfléchir à ces situations du quotidien via le prisme de la médecine d’urgence, car encore une fois un urgentiste n’est pas exposé aux mêmes contraintes logistiques qu’un réanimateur, et cela va avoir des conséquences très concrètes dans certaines situations.
Faut-il de la C-PAP (VS+PEP) ou de la VNI (VS+PEP+AI) dans l’OAP non hypercapnique ?
Les deux sont recommandés d’égale manière (7) (8), car le niveau de preuve est faible (9), le bénéfice sur la mortalité peinant à être mis en évidence malgré des résultats incontestables sur le confort et la détresse des patients. On sait donc que la C-PAP suffit pour obtenir l’amélioration clinique escomptée. Pourquoi faire de la VNI alors ? Pourquoi pas répondront certains. En effet, si résoudre une situation avec de la PEP semble améliorer nos patients, la résoudre avec de l’AI en plus, pourrait être encore mieux que bien. La question que l’on peut se poser est: est-ce que le mieux ne pourrait pas être l’ennemi du bien ? Je préfère couper court: nous n’en savons rien.
Mais d’autres études dans d’autres contextes (nous parlerons de l’Optiflow dans l’hypoxie sévère un peu plus tard), nous ont montré que parfois, donner de la VNI quand elle n’était pas nécessaire pouvait peut-être augmenter la mortalité (on ne sait pas comment, mais probablement par l’apparition de lésions induites par la ventilation, les « VILI » des anglo-saxon). Mon principe est donc d’aller au plus simple, je donne au patient ce qui est suffisant et reconnu pour l’améliorer (de la PEP), et rien d’autre, je ne fais jamais de VNI à un patient non chronique en OAP typique, avec à la phase initiale généralement une situation d’hypoxie / hypocapnie et pH normal voire alcalin de part sa polypnée majeure.
L’intérêt selon moi: ne pas risquer d’être peut-être discrètement délétère selon des principes encore méconnus, et surtout réserver les appareils faisant de la VNI (ventilateurs) à des situations le nécessitant vraiment. Cela devient très significatif l’hiver, lorsqu’on est amené à travailler dans un petit SAU avec un seul ventilateur, et qu’on se retrouve la nuit avec plusieurs détresse respiratoires. Si sur les trois présentes il y en a deux qui sont des OAP, vous serez heureux de les avoir traités avec des moyens simples comme une C-PAP de Boussignac, lorsque la troisième, véritable BPCO en acidose hypercapnique, débarquera avec réel besoin de votre seul ventilateur pour de la VNI BiPAP. Même sur un site plus lourdement doté, avoir trois déchocs et deux ou trois ventilateurs de bonne qualité n’est absolument pas du luxe lorsque les détresses respiratoires s’enchaînent au plus fort de l’hiver. Dans notre service il n’est pas rare de voir parfois apparaître des C-PAP de Boussignac sur le nez de patients décompensant à l’UHCD ou même en circuit long, le déchoc étant déjà saturé et les ventilateurs utilisés pour des intubés ou des BPCO en décompensation aiguë.
La simplicité de la C-PAP permet par ailleurs de ne pas s’exposer à plusieurs complications logistique gênantes: l’asynchronie patient/ventilateur, auquel peut être confronté un patient sous VNI mal réglée (notamment certains réglage constructeur mettant par défaut des trigger à 5 cmH2O ou des pentes aberrantes si le clinicien n’y touche pas, risquant de dégrader la tolérance du patient et donc son acceptation et la réussite de la séance), mais aussi la surveillance d’une séance de VNI, qui nécessite une compétence technique supérieure, plus d’attention à la mise en place et un recours plus régulier au médecin, de même dans la suite de la séance notamment pour vérifier que le patient n’est pas victime d’asynchronies avec la machine ou pour régler d’éventuelles alarmes.
Enfin, toujours en terme de logistique, la C-PAP type Boussignac est utile en SMUR pour ne pas avoir à trimbaler un respirateur, plus lourd, plus fragile, sur des interventions d’accès difficile, l’OAP simplex étant très fréquent en interventions SMUR et le bénéfice de la C-PAP en préhospitalier étant défendu dans plusieurs études bien que soumis à des limitations et biais (10).
Le plus grand risque de faire disparaître les C-PAP et de tout régler à la VNI à mon sens, est de faire entrer dans les mœurs le « tout VNI » sans individualiser les situations et leur physiopathologie, c’est à dire « OAP=VNI et BPCO=VNI » avec des protocoles et des réglages qui dans certains endroits pourront être bien définis et séparés en fonction des situations (en quel cas ça sera très bien), et dans d’autres, avec des équipes peut-être moins intéressées par le sujet, des situations moins bien individualisées, des protocoles trop rigides ou inadaptés, et progressivement des praticiens qui par raccourcis finiront par mettre dans toutes les situations cliniques le masque avec PEP=5, AI=12. Ces réglages par exemple seraient peu indiqués et largement optimisables en cas d’OAP cardiogénique pur.
Comment traite-t-on un patient à la fois en OAP et en décompensation de BPCO ?
Imaginons un patient BPCO sévère, appareillé d’une VNI de domicile, qui est admis pour un OAP très mal toléré avec cyanose, tirage, crépitants jusqu’à mi-champ. On se retrouve dans une indication de PEP « active » et une indication d’AI. Comment les prioriser ?
Dans tous les cas une seule chose à bien assimiler: la priorité est toujours à l’oxygénation, c’est de ça qu’il mourra très vite en quelques secondes à minutes, pas de son hypercapnie. Pour agir sur l’oxygénation deux paramètres majeurs, la FiO2 quand elle est réglable, et la PEP. On va donc commencer par régler une PEP active, entre 8 et 10 cmH2O, afin d’agir rapidement sur la cause de la détresse qui est l’œdème pulmonaire, avec une FiO2 suffisante pour SpO2 95% dans l’état de détresse initial, l’AI sera réglée à un niveau minimal soit 8 cmH2O.
Dès que l’œdème aura été traité par la PEP – et l’effet peut être très rapide en 20-30min – il sera déjà temps d’adapter les paramètres en diminuant la PEP (5-6mmHg) pour laisser plus de place à l’AI que l’on pourra monter progressivement pour débuter une séance classique de VNI visant à traiter l’hypoventilation alvéolaire (acidose hypercapnique) entraînée par cette décompensation et l’épuisement qui s’en est suivi.
Faut-il traiter par VNI un patient en acidose hypercapnique, mais non insuffisant respiratoire chronique ?
La réponse est oui, si on suit ce que je vous disais plus haut en terme d’indications de début de VNI (notamment les éléments gazométriques). En réalité la situation semble plus complexe que ça. Le niveau de preuve de la VNI concerne surtout les patients chroniques, les BPCO en particulier (4), mais l’acidose hypercapnique de patient à poumon sain / fonction ventilatoire préalablement saine est moins documentée. Le cas typique est un patient de 50 ans faisant un OAP massif à domicile. Il n’a pas de pathologie respiratoire chronique. Il n’a pas la force d’appeler à l’aide du fait de l’intensité de sa détresse hypoxique, finalement son épouse le découvre dans ce triste état et prévient les secours. Les pompiers le transportent tel quel sous O2 15L/min au MHC. En arrivant aux urgences il est toujours en détresse (l’O2 seul sans pression, n’a pas repoussé l’œdème, la cause de la détresse est toujours là), mais alors qu’il était initialement probablement normo-pH et hypocapnique comme un patient à la pompe respiratoire compétente, le délai de prise en charge a fini par l’épuiser, il a progressivement ralenti sa fréquence ventilatoire et diminué ses volumes, et a monté sa capnie et acidifié son pH.
Comment faut-il gérer son cas ? Comme le cas juste au dessus, priorité à l’oxygénation sans aucune hésitation, il recevra donc initialement de la PEP entre 8 et 10.
Et c’est ici que les avis divergent entre les équipes. Pour certaines équipes de réanimation, ce patient n’a pas le terrain pour qui la VNI est bénéfique. Malgré l’acidose hypercapnique, de la C-PAP suffit, en repoussant rapidement l’œdème réversible, il permettra à ce patient dont la pompe respiratoire est d’ordinaire compétente, de reprendre pied et de récupérer une fonction respiratoire normale de lui-même… et si il n’y parvient pas, c’est qu’il faut l’intuber. Bref la VNI ne trouve pas de place dans cette stratégie.
Pour d’autres, et ça serait le plus intuitif, acidose respiratoire sur une détresse = VNI, et traitement à peu près comme le patient BPCO du cas précédent, PEP initiale importante, puis switch progressif pour une ventilation plus équilibrée avec une PEP plus basse et une AI permettant d’équilibrer les gaz du sang sur une plus longue période. Il n’y a pas vraiment de niveau de preuve qui tranche pour l’un ou l’autre sur ces patients précis… j’ai déjà eu l’occasion de pratiquer les deux techniques, elles fonctionnent toutes les deux (oui, même la C-PAP pure… c’est un peu étonnant de voir une acidose hypercapnique régresser sous PEP seule). Rien ne me choque donc et je reconnais à chaque camp la liberté de choisir, mais je préfère la seconde méthode car elle est moins difficile à expliquer aux internes (qui ont déjà du mal à s’y retrouver), et permet de ne pas méconnaître un patient chronique qui s’ignorerait, et pourrait bénéficier de la VNI (soyez vigilants à l’HCO3 de la gazo intiale… s’il est élevé méfiance, le « sans antécédent respiratoire » est peut-être en réalité un BPCO qui n’est lui-même pas encore au courant).
Synthèse:
III) L’oxygénothérapie haut débit – Optiflow™
Cette thérapeutique récente, qui a une dizaine d’année en pratique clinique courante, consiste à administrer de très importants débits d’oxygène via des canules nasales en silicone adaptable de différentes tailles pour coller à la morphologie du patient avec un flux humidifié et réchauffé permettant une excellente disponibilité de l’O2 administré, avec notamment des FIO2 (réglables) considérées comme fiables, jusqu’à près de 100%, et un effet de lavage de l’espace mort de part l’importance du débit, permettant d’évacuer le CO2 expiré et de décroitre le travail respiratoire.
Les débits allant jusqu’à 60L/min couvrent ainsi les besoins du patient en terme de débit inspiratoire de pointe même en détresse respiratoire, et induisent également un effet PEP minime (11), par simple effet mécanique (vue l’importance des débits impliqués), qui à bouche fermée peuvent approcher des 3cmH2O (on peut lire davantage sur certaines références, jusqu’à 5cmH2O). En mode pédiatrique il est bloqué à un maximum de 25L/min de débit.
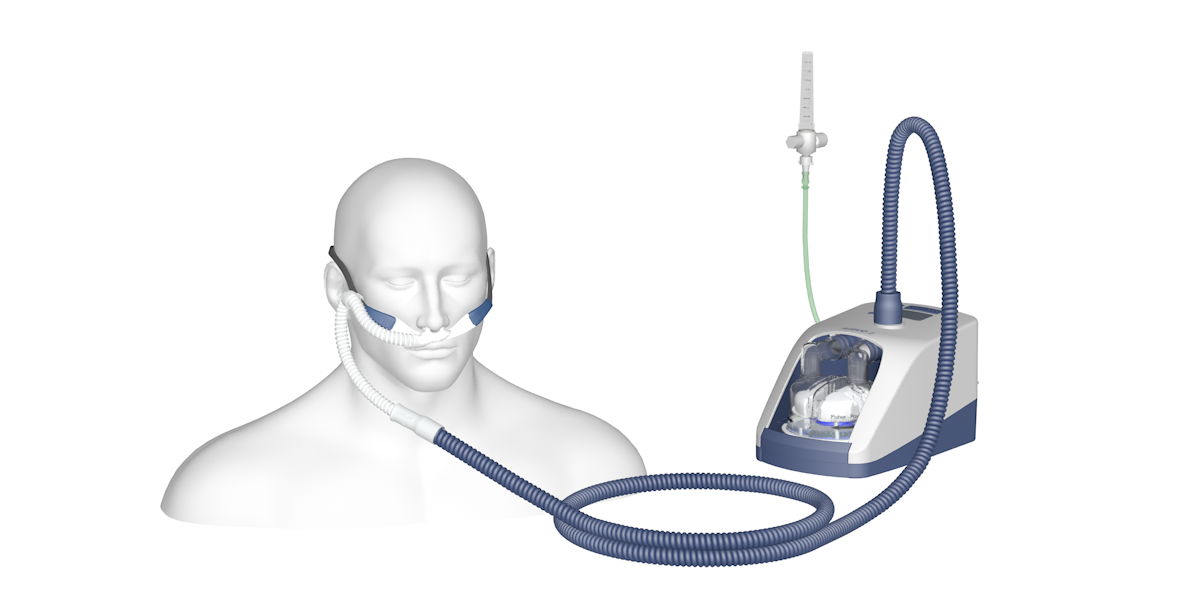 (AIRVO 2 dont nous sommes doté, permettant de basculer en mode adulte ou pédiatrique -circuits différents-)
(AIRVO 2 dont nous sommes doté, permettant de basculer en mode adulte ou pédiatrique -circuits différents-)
Les indications:
L’Optiflow est une thérapeutique de niche, en effet son indication est actuellement assez précise, en particulier en ce qui concerne le déchocage (car les indications de post-extubation et autre, intéressent moins les urgentistes). Il s’agit des hypoxémies sévères (en priorité les pneumopathies hypoxémiantes) sans OAP, et sans hypercapnie. Nous sortons ainsi de la situation où une PEP importante serait nécessaire pour repousser l’œdème dans une situation de réversibilité immédiate de la détresse (indication de C-PAP), et nous sortons du patient chronique ayant besoin d’un support de la pompe ventilatoire (indication de VNI), pour nous consacrer à des situations d’hypoxémie très sévères, sur des problématiques peu réversibles (pneumopathies installés) avec un patient ayant une pompe ventilatoire compétente.
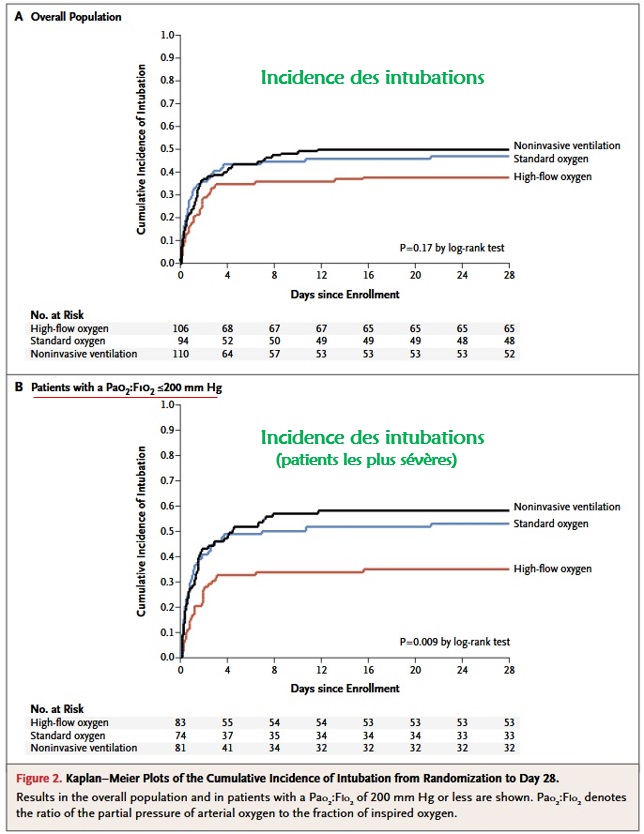
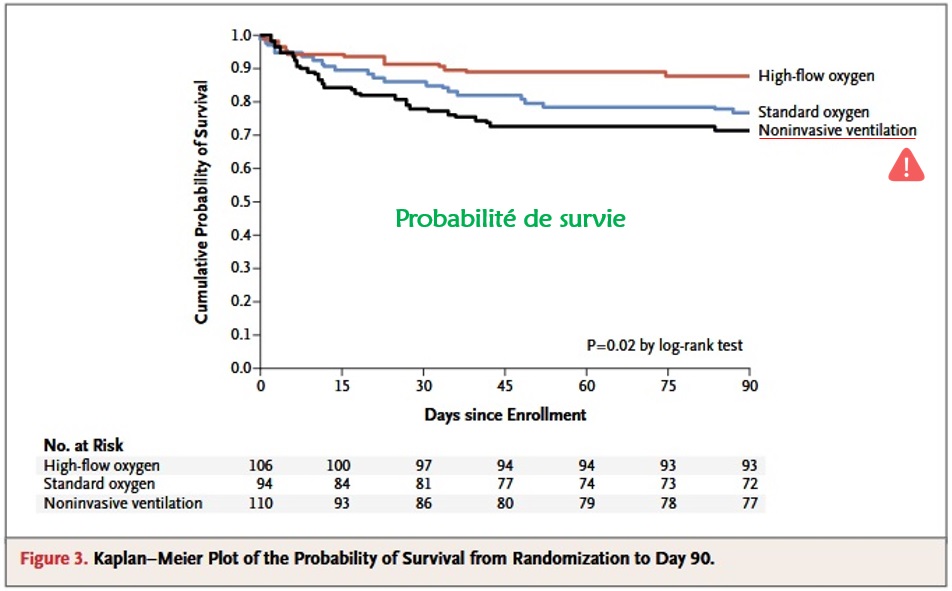
La principale étude à citer est FLORALI (5), qui bien que réalisée en réanimation et non aux urgences, a permis dans cette population très précise de confronter O2 classique, VNI (entrecoupée d’Optiflow pendant les pauses), et Optiflow continu.
Elle a mis en évidence une tendance significative de l’Optiflow continu à diminuer l’intubation (critère de jugement principal) et ce d’autant que le patient était sévère (PAFI<200mmHg), de même qu’une diminution de la mortalité à 90 jours (critère secondaire). Par ailleurs, l’une des observation surprenante de cette étude était une possible augmentation de la mortalité des patients traités par VNI, par rapport à ceux traités par O2 simple (dans la limite d’une observation faite sur un critère secondaire).
La VNI n’apportant ici en tout cas pas de bénéfice particulier, il semble raisonnable d’appliquer le principe de précaution et bannir la VNI de ces indications.
Le plus important dans l’oxygénothérapie haut débit, est de ne pas méconnaître une indication d’intubation, et si elle est présente, ne surtout pas retarder une intubation. En effet, l’un des « problème » de l’Optiflow est son effet souvent assez spectaculaire sur la tolérance de l’hypoxémie grave chez un patient initialement en grande détresse. L’amélioration parfois drastique peut faussement rassurer le médecin, et diminuer grandement sa vigilance et sa surveillance. Or le retard d’intubation est également un facteur de mortalité notable chez ces patients (12). Il convient donc d’être vigilant à des critères d’emblée dépassés, ou d’échec de la thérapeutique (apparition d’une hypercapnie, FR>40/min, mauvaise tolérance clinique avec tirage majeur, désaturation inférieure à 90% malgré l’optimisation des paramètres d’oxygénation…), ces patients doivent être surveillés comme le lait sur le feu avec réévaluation très précoce (dans la première heure), et l’intubation doit être la sanction immédiate sans perte de temps si l’amélioration n’est pas suffisamment complète, ou suffisamment rapide.
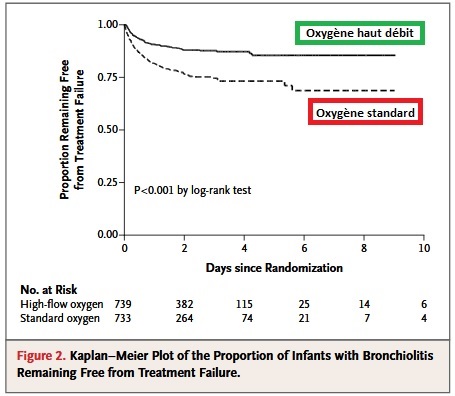
Par ailleurs il y a également une indication reconnue d’oxygénothérapie haut débit en pédiatrie notamment chez les nourrissons atteints de bronchiolite très hypoxemiante. L’intérêt de cette étude récente du NEJM (13) est qu’elle a été réalisée aux urgences. Les auteurs comparent l’O2 haut débit (de type Optiflow-AIRVO2 en mode pédiatrique et avec circuit adapté) à 2L/kg/min, à un bras témoin traité par O2 standard, chez des nourrissons de moins de un an atteints de bronchiolites sévères (nécessitant de l’O2). Le critère de jugement principal était l’obligation d’escalader sur des techniques de réanimation supérieures telle que la C-PAP pédiatrique, l’intubation, le transfert en réanimation… (donc un échec de traitement).
Les auteurs constataient une nécessité d’escalade thérapeutique moindre dans le groupe O2 haut débit (12%) en comparaison du groupe sous O2 simple (23%), et cet écart était d’autant plus important que l’hôpital concerné n’avait pas de réanimation pédiatrique sur place, dans ce cas l’escalade n’était que de 7% sous OHD contre 28% sous O2 normal (résultat intéressant pour les urgences de centres non CHU comme le nôtre faisant régulièrement du déchocage pédiatrique, et dont l’utilisation d’O2 haut débit permet parfois de sursoir à des moyens plus lourds tels que C-PAP ou intubation, et éviter un transfert au CHU).
Au total si le niveau de preuve est encore modéré notamment aux urgences, les résultats disponibles semblent déjà pouvoir rendre intéressant ce dispositif dans les pneumopathies hypoxémiantes sévères et mal tolérées en déchocage. Son utilisation est en revanche difficilement contournable aux urgences pour les enfants hypoxémiques graves notamment les nourrissons pris en charge pour bronchiolite sévère, en particulier en hôpital non-CHU sans réa pédiatrique.
De nombreuses études sont en cours notamment en France pour identifier les autres indications possibles de ce dispositif, notamment en alternance avec la VNI mais cette fois chez les BPCO en décompensation (lors des pauses entre les séances de VNI), ou encore dans les OAP à tendance hypercapnique chez sujets préalablement sain de part l’effet d’évacuation du CO2 et de diminution du travail respiratoire observé avec l’Optiflow.
Les réglages:
L’Optiflow se met en débit maximal d’emblée (60L), avec FiO2 réglée pour SpO2 95% dans notre protocole local (dans l’étude FLORALI ils visent une SpO2 >92%). L’interface est ici aussi capitale pour assurer le passage d’un débit optimal et maximiser l’effet PEP, il faut donc sélectionner des canules nasales de taille adaptée. Chez l’enfant, on appliquera 1 à 2L/kg/min de débit, sachant que la limite maximale est bloquée à 25L/min lorsqu’on passe en mode pédiatrique.
IV) Quels dispositifs pour la pré-oxygénation avant intubation
Généralités:
L’intubation oro-trachéale en médecine d’urgence est toujours une procédure critique, car il s’agit systématiquement d’une intubation en séquence rapide (ISR) en conditions sub-optimales, chez un patient en état critique non préparé au préalable.
Les axes majeurs qui pourront être responsables de la mort du patient lors de son induction, sont l’oxygénation et l’hémodynamique. Ces axes doivent donc s’anticiper à tout prix et être optimisés avant de se lancer dans la procédure d’ISR.
Au niveau hémodynamique, un pré-remplissage de quelques centaines de millilitres est devenu l’usage dans beaucoup d’équipe afin d’assurer un support volémique minimal et une petite réserve supplémentaire de pré-charge (généralement 250-300cc chez nous). On peut également dans les situations les plus à risque faire courir un PSE de noradrénaline de basse dilution juste avant et pendant la procédure, sans oublier bien sûr d’avoir prêtes à l’emploi des drogues d’urgence (Ephedrine, Adrenaline 0,1mg/mL).
Choix d’un dispositif d’oxygénation:
Au niveau de l’oxygénation, il s’agit à peu près de la seule situation où nous allons viser une SpO2 à 100%. En effet, la procédure étant très courte, on craint moins les complications au long terme d’une hyperoxygénation, et on cherche en revanche à se donner le maximum de réserve en oxygène afin d’autoriser un délai de procédure le plus long possible (pour palier à tout imprévu comme l’intubation difficile, l’échec d’intubation avec multiples tentatives…).
Dans ce contexte il faut différencier les patients non hypoxémiques, des patients hypoxémiques. L’adage décrit au dessus est toujours valide: l’oxygénation est toujours la priorité des priorité, c’est l’hypoxie qui tue. Il n’y a que chez un patient recevant une ISR pour un motif non respiratoire (exemple un coma, eupnéique en air ambiant, sans aucun facteur de risque en terme de désaturation comme une obésité, une BPCO) que l’on peut considérer une préoxygénation à l’oxygène simple à 15L/min sans autre support.
Ainsi une étude récente (14) a contribué à balayer les conseils de prudence incitant à ne pas ballonner au BAVU un patient avant de l’intuber pour éviter les insufflations d’air et les régurgitations… chez un patient grand hypoxique, l’intubation sera très périlleuse, on veut lui éviter de mourir avant de lui éviter d’inhaler en per-procédure, il est donc tout à fait possible et même souhaitable de ballonner ces patients à 100% de FiO2 pendant l’apnée afin de garder le plus de chances de ne pas désaturer pendant la laryngoscopie.
Dans l’idéal quand ces dispositifs sont accessibles, il est toujours préférables d’oxygéner avec une PEP significative afin de garder un maximum d’alvéoles recrutées même en apnée, et d’augmenter la CRF notamment chez les patients obèses avec de potentielles atélectasies à l’état de base. Cela est possible avec un simple BAVU en rajoutant une valve de PEP (et en veillant à diminuer le rythme du ballonnement, pour ne pas surdistendre les poumons). L’autre possibilité est de réaliser toute la pré-oxygénation à la C-PAP, ou encore à la VNI (15) avec des réglages basiques (PEP 5-6, AI 8, FiO2 100%), même au minimum, ces réglages seront beaucoup plus effectifs qu’un BAVU pour pré-oxygéner et prévenir les désaturations per-procédure (16). Il m’arrive de régler la VNI avec des PEP supérieures (8 par exemple) lorsque les patients sont hypoxémiques très sévères. La durée de la préoxygénation est de 3 à 5min.
Les études se tournent pour les prochaines années, sur la fameuse oxygénation d’apnée dite « ApOx » chez les anglosaxons, qui vise à continuer à oxygéner le patient même quand on retire le masque de C-PAP / VNI le temps de réaliser la laryngoscopie. Plusieurs protocoles sont testés, notamment en France avec la combinaison de VNI et d’Optiflow, ce dernier restant en place lorsque le masque de VNI est retiré (17).
V) Conclusion
- La détresse respiratoire aux urgences nécessite le choix du bon dispositif en fonction de la pathologie suspectée mais aussi parfois du contexte logistique et de l’environnement propre à la médecine d’urgence.
- La C-PAP est un outil très utile en urgence/SMUR de part sa rusticité, sa simplicité, et l’absence de preuves supérieures en faveur de la VNI (BiPAP) dans l’OAP.
- Quelque soit la pathologie, l’oxygénation urgente est toujours la priorité, c’est l’hypoxie qui tue.
- La VNI (BiPAP) est devenue essentielle et incontournable aux urgences, elle est indiquée en première intention dans les décompensations de BPCO, où elle a prouvé diminuer mortalité et taux d’intubation. Elle n’est pas indiquée dans les pneumopathies hypoxémiantes non hypercapniques, et pourrait même être délétère.
- L’oxygénothérapie haut débit (Optiflow) est une thérapeutique nouvelle et peu documentée aux urgences. Elle semble intéressante pour les pneumopathies hypoxemiantes non hypercapnique et les bronchiolites sévères du nourisson.
- La préoxygénation d’un patient avant intubation en séquence rapide doit être optimisée en fonction du terrain et de la pathologie. Tout hypoxique sévère devrait être préoxygéné avec de la VNI (BiPAP).
Biblio:





Petite question sur VNI et BPCO.
La PEPexterne appliquée vise à lutter contre l’autoPEP si j’ai bien lu.
Mais n’y a t il pas un risque d’hyperinflation dynamique ?
Et merci pour ce topo clair net qui remets les choses au clair, même quand on les pratique régulièrement.
Salut, merci pour la question.
En effet une PEP externe inutilement élevée peut favoriser l’hyperinflation dynamique de même qu’une AI trop élevée… hélas à moins d’être en réanimation avec des moyens lourds (mesure P.oesophagienne) on ne peut pas connaître cette limite précise de PEPi en VNI de routine aux urgences, alors on doit appliquer des paramètres prudents: PEPe 4-6 en surveillant la tolérance et le minimum suffisant pour récompenser les efforts inspiratoires / le confort du patient, une AI (une fois la situation commençant a être maitrisée et le niveau optimal atteint pour répondre à la détresse) la plus basse possible sans qu’il y ai de répercussion clinique (si le patient a la même FR et réussite de séance à 14 d’AI et à 12 d’AI, autant diminuer à 12, et continuer à décroître au fur et à mesure du succès de la séance sur la mécanique ventilatoire du patient), et veiller à bien optimiser pente et cyclage pour laisser le maximum de temps à l’expiration.
De même au cours d’une séance qui se passait jusque là bien, si en cours d’augmentation progressive d’AI (avec une amélioration continue à chaque augmentation de réglage) le patient commence à dégrader sa fonction ventilatoire brusquement passé une certaine AI avec d’importantes asynchronies patient/ventilateur, c’est probablement qu’il faut diminuer l’AI car on se met à favoriser l’hyperinflation dynamique et on entre dans un cercle vicieux qu’il faut désamorcer.
Il y a donc un équilibre à trouver entre PEPe insuffisante (avec comme résultat une PEPi insuffisamment compensée), AI insuffisante (séance pas assez efficace, non résolution de l’acidose respiratoire), et l’excès inverse qui va créer de l’hyperinflation dynamique et de l’asynchronie patient/ventilateur.
GOOD,thaks a lot
Merci, simple, détaillé, …..explicite dans les détails d’indications réelles de VÑI…
MERCI
Comment pourrait t’ on arrêter de prescrire des volumes de l’ordre de 6L/MN avec un MHC ?
Nous avions fait dans le service une étude sur les débits avec un masque à haute concentration qui avait été publié dans la revue urgence pratique qui rejoint vos conseils devant les ré inhalation de CO2 constatée.
Que pensez vous des nouvelles recommandations en secourisme sur l’utilisation des MHC qui indique qu’il faut diminuer les débit pour atteindre l’objectif d’une SPO2 entre 94 et 98% sur des détresses respiratoires ?
Ce que j’en pense ? Pas grande chose si ce n’est que c’est pas trop tôt.
La gestion de l’oxygène victime des soucis de simplifications faits par le passé pour les formations grand public, fait partie du gros point noir des référentiels secouristes depuis des années malgré des découvertes majeures dans le domaine.
L’oxygène est un médicament et doit être utilisé comme tel, sur un objectif (94-98% pourquoi pas), et pas larga manu, à l’aveugle, pour tout et rien.
Les deux seules situations secouristes nécessitant le 100% de spO2 à l’aveugle et en systématique sont l’intoxication aux fumées et / ou suspicion d’intoxication au CO d’une part, et l’accident de plongée d’autre part… on ne peut pas dire que ça soit la majorité des interventions.
Dans tous les autres cas, on vise un objectif cohérent, une fourchette de saturation. Il n’y a que deux choses à retenir sur l’O2 secouriste: on meurt rapidement d’hypoxie, donc ne pas limiter un débit « pour le principe » (comme par exemple « il est BPCO alors je lui ai mis que 3L » alors qu’il est bleu marine en détresse respiratoire), et de l’autre côté, l’hyperoxie n’a aucun intéret pour le patient, donc on vise une fourchette et on s’y tient.
On apporte le nécessaire pour atteindre les chiffres viséz, si on ne l’atteint pas on laisse à fond, si on la dépasse on diminue.
Ce n’est pas plus compliqué.
Une détresse respiratoire qui a 95% de spO2 n’a pas besoin d’un plus important débit d’oxygène… elle a besoin qu’on traite la cause de sa détresse, et on entre dans le secours spécialisé.
Bonjour,
J’ai un patient en choc cardiogénique / SCA ST+. A J2 d’hospitalisation, il a toujours 15gamma/kg/mn de dobu et un peu de noadré mais sans signes d’hypoperfusion périphérique, ni lactates. Là, on constate un OAP donc traitement médicamenteux puis VNI (on n’a pas de CPAP), on règle une PEP à 8cmH2O et une AI à 8cmHO, les réglages fins sont standards. Et là on a une FR à 25cycl/mn environ et un Vt de 10mL/kg voir 12 / 14 mL/kg sur certains cycles… Par ailleurs, le patient tolère bien la ventilation non invasive. Que faire pour se rapprocher d’un Vt à 6 / 8 mL/kg?
Bonjour Antonin,
L’objectif du blog n’est pas trop les réactions directes et échanges sur des cas en cours, (même si ça se fait ailleurs et sur les réseaux sociaux) surtout qu’on ne peut pas juger efficacement d’un cas critique et complexe sans être devant le patient, et avec quelques éléments communiqués seulement.
Enfin sur ton cas particulier en dehors du traitement de la cause (j’imagine que la coro est déjà passée par là), dans un contexte de choc cardiogénique ischémique l’origine de l’OAP étant possiblement une incapacité du cœur à fonction altérée à gérer la volémie qu’on lui impose, je serais agressif sur les diurétiques surtout en priorité numéro 1, avec de fortes doses en pousse-seringue, par ailleurs s’il s’agit réellement d’un OAP sans acidose hypercapnique gazométrique, la PEP (que nous mettons plutôt à 10 qu’à 8), semble le traitement le plus adapté, si le patient reste polypnéique et avec des Vt au dessus des objectifs attendu pour le poids idéal théorique, c’est peut-être qu’il n’a pas besoin d’être aidé pour prendre des Vt plus grands (AI peu ou pas utile), mais qu’il a besoin que la cause (l’OAP) soit réversée, et c’est le travail de la PEP, qui peut montrer des bénéfices jusqu’à 10cmH2O (idéal) voire davantage si vous avec de quoi monitorer correctement.
Éventuellement les inotropes comme la dobu sont utilisés dans un second temps comme ici, mais sur un choc cardiogénique impliquant un cœur en souffrance post-IDM, personne n’a la garantie ni la preuve bibliographie solide qu’on sauve plus de vies en lui demandant un travail supplémentaire à celui qu’il fournit déjà (par un inotrope tel que la dobu), le plus simple est de diminuer le travail qu’on lui impose (diurétiquer agressivement + PEP maximale raisonnable). Généralement chez ces patients nous sevrons la dobu en premier, puis diminuons au possible la noradré très lentement sous fortes doses de diurétiques et avec la PEP nécessaire pour lutter contre l’apparition de l’oedème.
C’est en tout cas comme ça que je le traiterais chez moi. Le plus raisonnable et de staffer le patient chez vous à plusieurs, à son chevet et avec tous les éléments en main. Bonne continuation.
Bonjour,
Merci pour cet article très bien fait et qui remet bien les indications en tête de ces différents mode de ventilation ! Petite question, sur les patients en DRA notamment les personnes âgées, avec une étiologie un peu mixte sans une étiologie franche (un peu de décompensation cardiaque, bronchite ect..) est ce que le fait d’apporter une AI ne soulagerait pas leur travail ventilatoire même s’il n’y a pas d’hypercapnie ? Dans un contexte où ce sont des patients pour qui il n’y a pas forcement de projet de réanimation derrière. Merci !
Salut Fanny,
Il n’y a pas que l’AI, la PEP aussi est capable de soulager le travail ventilatoire, déjà en diminuant l’effet shunt quelque soit la cause, ce qui permet au patient de mieux rentabiliser sa ventilation, et ensuite en agissant sur une potentielle auto-PEP même minime, et sur l’éventuelle part cardiogénique de cette détresse mixte, puisque l’indication idéale de la PEP est bien l’OAP. C’est pourquoi des services de médecine expérimentent l’Optiflow en secteur non critique (lit d’hospitalisation, de gériatrie, et dans certains UHCD aux urgences aussi) à visée « confort » voire « palliative » chez certains patients défaillants respiratories pour qui on cherche à passer un cap sans escalader les soins au delà, et sachant que c’est très bien toléré et reposant.
Le problème de la VNI est que ça nécessite une équipe entraînée, que ça monopolise un ventilateur et un box de déchocage, et que ça nécessite une certaine surveillance et du temps médical pour ajuster les éventuelles asynchronies, par ailleurs une séance de VNI est éprouvante et son indication dans le « confort » est possible au cas par cas mais discutable, et doit surtout être envisagée dans l’espoir de passer un cap. Sachant qu’on est la plupart du temps en manque de ce matériel et de ce temps pour nos patients graves, faire de l’accompagnement à la VNI ne s’imagine selon moi pas aux urgences, où il y a d’autres patients ayant besoin de ces ressources de manière cette fois urgente et parfaitement indiquée. Ici, nous acceptons parfois de tels patients en USC et les gardons quelques jours le temps de voir si on peut passer un cap avec de l’Optiflow (si absence d’hypoventilation alvéolaire).
Chez un patient sans hypoventilation alvéolaire authentifiée (gazo sans acidose hypercapnique), il n’y a pas de francs arguments nous disant que des dispositifs plus lourds font mieux sur le travail ventilatoire. Il n’y a pour nous pas de critère d’AI, et l’O2 haut débit marche aussi très bien avec son effet PEP pour soulager un peu le travail, à des niveaux de détresse plus modérés sans retentissement importants.
Il faut également se méfier du « mieux, ennemi du bien », le patient que tu proposes ici pour de la VNI, commence à s’approcher de la population étudiée dans FLORALI, qui sont des patients sans acidose respiratoire, hypoxémique, a qui on proposait pourtant de la VNI BiPAP, avec les résultats que l’on sait (tendance à avoir de plus mauvais chiffres de survie que l’Optiflow et même que l’O2 simple au masque ou lunettes, sur des analyses de critère secondaire). Ce qui semble logique et de bon sens de prime abord n’est pas toujours profitable au patient… je pense qu’actuellement essayer de l’O2 haut débit (type Optiflow) avec la plus faible FiO2 possible et un débit à 50-60L pour effet PEP, est l’hypothèse la plus intéressante pour ces patients, avec même possibilité de le faire hors de services critiques puisque pas de projet de réanimation derrière.
MERCi ppour ce papier qui permet de remettre en ordre toutes les notions que l’on a appris à droite à gauche. on se sent plus intelligent et plus compétant après avoir lu.
Merci pour la lecture, et le commentaire, même si c’est beaucoup attribuer à cet article.
Ne pas hésiter à faire tourner si il a pu servir, il servira peut-être à d’autres.
Merci pour ce beau travail, c’est très clair ! Bon courage.
Salut Aymeric et merci pour ton commentaire…
Je te retourne la question, as-tu déjà respiré dans un BAVU ? Ici on le fait quasiment à tous les semestres pour faire tester aux internes les sensations avec BAVU, CPAP, VNI… et il n’y a aucune difficulté à respirer dans un BAVU simplement plaqué hermétiquement et raccordé à de l’O2 15L sans ballonner à la main (le modèle est le plus courant, le SPUR II jetable de Ambu).
Il y a de la confusion dans ton explication, lorsque tu ventiles spontanément dans un BAVU, ce n’est pas la chambre en « caoutchouc » qui va se déprimer lorsque tu inspires, mais le sac collecteur d’O2 juste après, en plastique et sans aucune résistance (c’est le même sac que celui du MHC de 15L/min des urgences). Fait l’essai, plaque bien le masque du BAVU, et ventile, tu vas voir que la grande chambre en caoutchouc ne frémis même pas et ne se déprime pas, pendant que le sac plastique saturé d’O2 derrière imprime des mouvements respiratoires calqués sur les tiens.
Il y a en effet un espace mort en ce qui concerne la grande chambre en caoutchouc (qui n’est plus du caoutchouc mais tu vois de quoi je parle), mais contrairement à l’espace mort d’un tuba étroit (donc résistant à l’écoulement des fluides tels tes gaz respiratoires) en mer, que tu ressens réellement et qui peut être gênant, une chambre d’1.5L de contenance et sous la forme d’un large ballon n’a aucune résistance et n’est pas spécialement gênantes (si tu la garde une demi-heure je ne dis pas, un BAVU n’est pas confortable, mais ce n’est pas l’objectif), par ailleurs cette chambre n’est pas reliée à rien, elle est reliée à un débit d’arrivée d’O2 continu à 15L au minimum (nous on met plutôt le débit-litre allant jusqu’à 30L/min). En somme c’est comme respirer dans les grand casques « helmet » des CPAP helmet des italiens, la valve de PEP de sortie en moins. Ce sont de grands espaces, il n’y a donc que peu de résistance.
Et la ventilation y est si peu difficile spontanément, que c’est ce que l’on fait quand on induit un patient qu’on ne préoxygène qu’au BAVU avant de l’intuber (c’est plutôt rare mais ça m’arrive encore quand ils vont très bien et sans hypoxémie ni comorbidité). Quand les drogues sont poussées, on le laisse ventiler spontanément dans le ballon, puis on attend tranquillement qu’il se mette en apnée le masque plaqué, et une fois que c’est fait, on retire le BAVU et on s’expose… tout du long il a respiré seul, jusqu’à l’apnée, et sans difficulté particulière tu pourras le constater.
J’aimerais donc beaucoup que tu me dises où tu as vu qu’ils « montaient leur CO2 de façon dramatique » (c’est une question rhétorique bien entendu, car c’est faux). Je suis prêt à entendre et discuter beaucoup de choses sans problème, à commencer par le fait que simplement plaquer un masque (et le problème est le même pour le masque de la CPAP ou de la VNI) fait parfois paniquer le malade surtout grand hypoxémique, qui le rejette en disant qu’il étouffe, c’est un tout autre problème et l’agitation au moment de l’oxygénation se gère d’une autre manière. Mais non, je ne conviens pas avec toi qu’un BAVU « étouffe » un patient si on ne ventile pas manuellement avec. Ça serait mal comprendre son fonctionnement.
Bonjour,
je voulais réagir par rapport au papier de la New England « Bag-Mask Ventilation during Tracheal Intubation of Critically Ill Adults » cité en (14) dans votre article ->
L’objectif principal de cette article était de comparer la saturation la plus basse entre ceux ventilés avec 5-10 de PEP + 10 de Fréquence respiratoire avec un Vt minimal (afin de faire bouger la cage thoracique) et ceux non ventilés.
Il n’est pas question dans cet article de complication de cette méthode -> il ne s’agit pas du tout comme vous dites de voir si cette méthode donne plus de régurgitation ou d’insufflation gastriques.
Bonjour Toni merci pour le commentaire,
En effet l’étude citée ne traite pas de ces complications. Elle a en revanche amené certains à revenir sur les recommandation de ne pas ventiler à l’induction, recommandations qui avaient en partie pour justification le risque de survenue de ces complications de régurgitation (influant sur la balance bénéfice / risque du geste). C’est ce que j’ai voulu dire à travers ma phrase, et sa conclusion: que ces complications aient lieu ou pas, l’apport de cette étude montre un bénéfice à la pratique de ventilation pré-IOT sur un critère clinique important (la qualité d’oxygénation, qui n’est certes pas un critère direct de mortalité, mais qui compte, surtout chez les grands hypoxémiques dont on parle dans le topo), susceptible de balayer les anciennes pratiques, basées sur la prudence et la crainte des dites complications.
Je n’ai pas voulu faire un lien direct entre l’étude et les dites complications, qui n’est effectivement pas son objectif. En relisant cette phrase suite à cette remarque, elle me donne toujours l’impression de l’époque et me semble claire, mais je comprends à la lumière de ce commentaire qu’elle puisse être comprise différemment car tout est compris dans la même phrase: changement de paradigme suite à l’étude, et justification probable des anciennes recommandations (basées sur les complications). Est-ce plus clair avec cette explication ? Je vais demander à d’autres collègues sans à priori de lire ce passage pour avoir leur ressenti. Je n’exclue pas une modification / reformulation si ça pose problème.
Merci de ces remarques.
merci pour ce topo très clair, très pédagogique. Ca remet l’église au centre du village 😉
Pascal C
Merci pour le commentaire, c’est le but de l’article, n’hésitez pas à diffuser si ça peut servir.
merci
c’est clair et bien fait, Merci
Merci INFINIMENT pour votre article, qui m’a littéralement sauvé pour mon examen de physio respiratoire !
Bonjour
mon fils est décédé la semaine dernière à l’hôpital, il a été opéré du cœur. à cœur ouvert.
L’opération a été longue et difficile.
Mais il s’est réveillé le lendemain.
Pendant les deux jours suivants tt ses examens étaient bon et on nous disait que ça allait dans le bon sens.
Il était cependant douloureux et désaturait souvent même avec l’opti flow. Et il commençait à avoir du liquides dans les plèvres.
La décision a été prise de le mettre sous Masque Vni, il avait 3 ans, du coup masque total.
Lucas s’est énormément débattu, mais on lui a forcé la main à garder le masque pendant que l’interne régler la machine.
Le petit se débattait, puis il a fait un arrêt respiratoire puis un arrêt cardiaque.
Aujourd’hui j’ai le sentiment que le masque a été le déclencheur de cet arrêt et que si on lui avait mis différemment, la situation aurait pu être différente.
Je ne suis ni infirmière, ni médecin mais nous étions présents quand cela est arrivé et quand je lis les indications pour l’utilisation de la vni je me rend compte que la manière de faire pr Lucas n’a pas été respecté.
Pour moi il a été étouffé. Et cette idée et cette image me hanteront tte ma vie.
Bonjour monsieur,
Je ne suis pas du tout au fait du dossier mais d’un point de vue généralité je peux dire ceci:
Les recommandations longuement détaillées ci-dessus valent pour l’adulte, elles n’abordent pas les spécificité chez l’enfant. L’utilisation de la CPAP-VNI dans un contexte de réanimation se fait régulièrement sur des patients en détresse respiratoire extrême, qui même chez l’adulte peuvent donner une impression d’étouffement et peuvent être très périlleuses à mettre en place. Le témoin extérieur de la scène n’est pas le seul à penser que c’est le masque qui étouffe au lieu de sauver, le patient a souvent la même impression et repousse parfois le masque de la main / se débat beaucoup. Ce n’est cependant par la VNI le problème mais la pathologie sous-jacente (on est parfois obligés de sédater légèrement ces patients pour leur faire accepter le masque). Ces situations nous les avons tous vécues, elles n’apparaissent pas dans un manuel apprenant les bases de la VNI, mais elles surviennent régulièrement.
Quelque soient les soins entrepris, et l’expertise de l’opérateur, l’échec de VNI est toujours une possibilité qu’on ne peut jamais écarter, d’autant plus sur des situations de suites opératoires très lourdes.
Vous pouvez en parler avec l’équipe médicale qui a été en charge de votre fils, la commission des usagers de votre hôpital est disponible pour entendre les questions des familles et si besoin apporter des explications et compléments d’information qui pourraient vous êtes salvateurs, de même qu’un suivi par un psychologue face au traumatisme d’un tel événement.
Bon courage pour la suite,
Rhazelovitch